Índice de contenidos
Introducción
La hipertensión arterial a menudo se le conoce como el asesino silencioso, y es que es un factor de riesgo muy importante para el desarrollo de enfermedades renovasculares el cual no produce ningún tipo de signo o síntoma y que es relativamente común entre los ususarios de anabolizantes y muy a menudo, pasada por alto.
En este artículo, hablaremos del uso de anabolizantes y de su relación con la hipertensión arterial.
La hipertensión arterial
En la tensión, tenemos dos cifras, una más alta, a la izquierda, denominada presión arterial sistólica, que es debido a la contracción del corazón. La otra, a la derecha, es la presión arterial diastólica que es el valor más bajo, debido a la relajación del corazón.
El valor de la presión arterial sistólica y diastólica es expresado en milímetros de mercurio (mmHg). Se deriva del momento en que la presión arterial todavía se medía con manómetros que contenían mercurio. Una medida típica de presión arterial podría ser 120/80mmHg, o, en otras palabras, una presión arterial sistólica de 120mmHg y una presión arterial diastólica de 80mmHg.
La clasificación de la presión arterial por la Sociedad Europea de Hipertensión se da en la siguiente imagen:
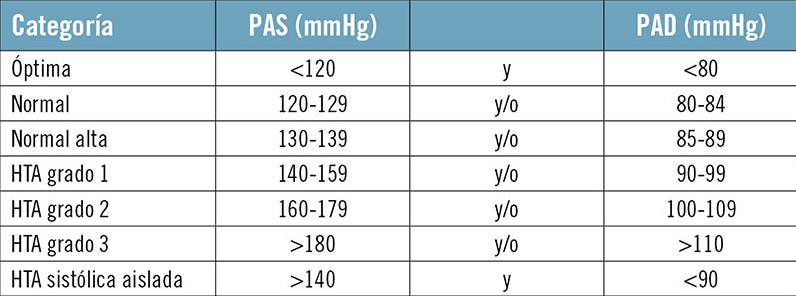
Imagen 1: Clasificación de la tensión arterial por la Sociedad Europa de Hipertensión [1].
Pero, ¿qué significan estos valores en términos de riesgo? Una colección de estudios observacionales [2] muestra que la mortalidad por enfermedad coronaria y accidente cerebrovascular aumenta con una presión sistólica superior a 115mmHg y una presión diastólica superior a 75mmHg.
Por encima de estos valores, con cada incremento de 20mmHg en los valores de tensión arterial sistólica y de 10mmHg en los valores de tensión arterial diastólica, duplica la mortalidad por enfermedad coronaria y accidente cerebrovascular.
Esto nos deja con la incógnita de si bajar o no la presión arterial con medicamentos funciona de cara a reducir estos riesgos y, como era de esperar, lo hace; Un metanálisis muestra que cada disminución de 10mmHg en la presión arterial sistólica reduce el riesgo de eventos cardiovasculares en un 20%, de enfermedad coronaria en un 17%, de accidente cerebrovascular en un 27%, de insuficiencia cardíaca en un 28%, y de mortalidad por todas las causas en un 13% [3].
Asimismo, el padecer hipertensión durante un período sostenido de tiempo daña de forma irreversible ciertos órganos, daño no se deshace cuando se inicia la medicación o la actuación enfocada a la normalización de la presión arterial.
Y, como apunte final, otro metanálisis sugiere que la reducción de la presión arterial en la prevención primaria solo es útil para aquellos con una presión arterial sistólica de 140mmHg o superior [4]. Si el nivel inicial es más bajo, generalmente no confiere ningún beneficio en cuanto a mortalidad o riesgo de enfermedad cardiovascular, de modo que esto nos aporta un buen punto de referencia en cuanto a decidir si tratar o no la presión arterial, sin embargo, cabe destacar que las características de los usuarios de anabolizantes son más similares a los del primer estudio, ya que se dan otras comorbilidades como obesidad muscular, hipercolesterolemia, anomalías estructurales y eléctricas en el corazón, etcétera.
En torno al uso de AAS y su impacto en la hipertensión arterial, hay datos contradictorios; algunos estudios muestran una asociación mientras que otros no. Estos resultados discrepantes pueden atribuirse en parte al pequeño número de sujetos inscritos en estos estudios.
Los datos limitados sugieren que el uso de AAS está asociado con hipertensión sistólica y diastólica, y la asociación es más fuerte con una mayor duración del uso de AAS. Aunque el mecanismo exacto sigue sin estar claro, parece ser que la inhibición de la 11β-hidroxilación por los AAS (más concretamente afecta a la 11b-HSD2), lo que resulta en la activación del receptor de mineralocorticoides inducido por el cortisol, sea una vía que esté implicada.
Activación del receptor de mineralocorticoides inducido por el cortisol: Los esteroides anabólicos androgénicos son agentes que afectan negativamente a la actividad de la 11β-hidroxiesteroide deshidrogenasa tipo 2, de esto con lo que tienes que quedarte es que dicha enzima ayuda a convertir el cortisol y la corticosterona en formas inactivas, lo que quiere decir que habrá un exceso de estos dos, y se ve que cuando esto ocurre, estas hormonas son capaces de activar el receptor de mineralocorticoides, lo cual no debería ocurrir de forma significativa en condiciones normales, de una forma similar a la que lo haría la aldosterona.
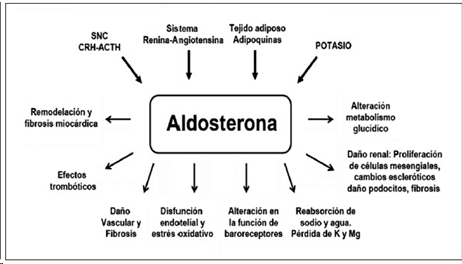
Imagen 2: Efectos fisiológicos de la aldosterona
También se ha demostrado que los andrógenos inhiben la captación extraneuronal de catecolaminas y estimulan la retención de sodio y agua, de hecho, en un estudio de hombres con panhipopituitarismo, la administración de testosterona se asoció con un aumento de la cantidad de agua extracelular (ECW), que además aumentó cuando se añadió hormona de crecimiento al régimen [5].
En otro ensayo que incluyó hombres de 65 a 90 años, el reemplazo con testosterona se asoció con un aumento de la presión arterial sistólica y diastólica (aunque los niveles absolutos permanecieron dentro del rango normal), con un tercio de los participantes informando de la aparición de edema en las extremidades inferiores [6]:
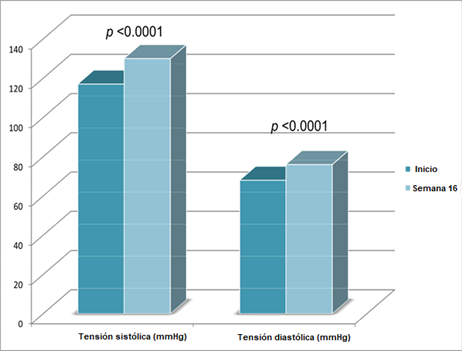
Imagen 3: Cambios en la tensión arterial de los sujetos del estudio, el incremento en la tensión arterial sistólica y diastólica fue de 12 ± 14 y 8 ± 8mmHg, respectivamente [6].
Solución a la hipertensión
Cabe destacar que, en los usuarios de esteroides, la hipertensión es más un signo de que algo va mal en lugar de la raíz del problema, es decir, cuando se ha produido un daño considerable en el sistema cardiovascular cuando esta suele aparecer.
Esto se debe a que, el uso de anabolizantes, da lugar, entre otras cosas, a algo que se conoce como la sobre-activación de la cascada del RAAS (Sistema renina-aldosterona-angiotensina); esta una cascada hormonal liberada en el riñón y en las adrenales involucrada en el control de la tensión arterial y daño tisular, entre otros procesos.
Las dos principales moléculas efectoras (angiotensina 2 y aldosterona), producen una cascada de señalizaciones moleculares que conducen a una serie de eventos pro-oxidativos, fibróticos, inflamatorios y vasoconstrictores.
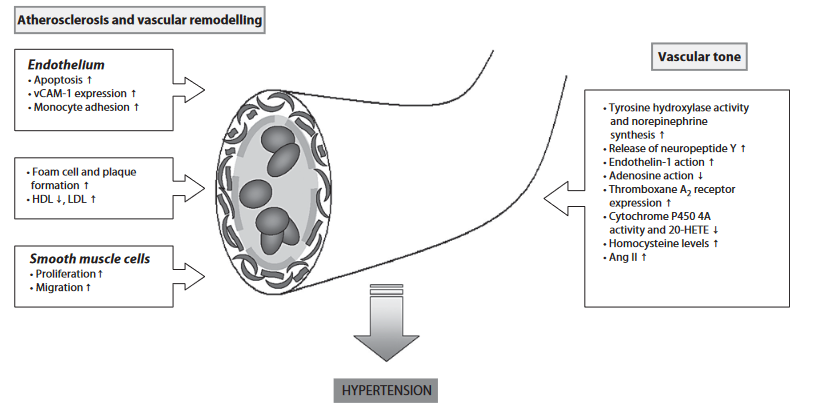
Imagen 4: Remodelación y daño vascular causada por el uso de andrógenos.
Conociendo los mecanismos, parece ser que la opción más idónea es la prevención con el uso de agentes que bloqueen ya sea la formación de angiotensina 2 o la unión de la misma con el receptor de angiotensina 2 tipo 1 (AT1), lo cual pasaremos a explicar ahora a continuación.
Inhibidores de la enzima convertidora de angiotensina (iECA)
En primer lugar, vamos a repasar los conceptos básicos para poder comprender debidamente toda la información que se expondrá a continuación.
En condiciones fisiológicas normales, la renina es una enzima liberada por los riñones en respuesta a una caída en la presión arterial. El sustrato de esta enzima es angiotensinógeno, que es producido por el hígado. Cuando la renina actúa sobre este sustrato, produce el péptido pequeño angiotensina I.
Luego se procesa más mediante la división en dos aminoácidos adicionales para formar angiotensina II. La enzima responsable de esto es la enzima convertidora de angiotensina (ECA). La angiotensina II produce vasoconstricción, predominantemente en las arteriolas.
Esto conduce a una mayor resistencia vascular y, por lo tanto, a un aumento de la presión arterial. Otra forma en que la angiotensina II aumenta la presión arterial es aumentando la cantidad de fluido extracelular al disminuir la excreción de sal y agua vía renal, o, en otras palabras, inhibe la diuresis (excreción de agua) y la natriuresis (excreción de sodio).
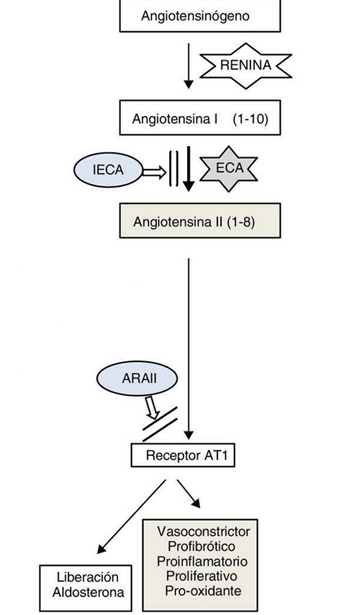
Imagen 5: Resumen básico de la cascada RAAS.
Esto es, en parte, también mediado por la estimulación de las glándulas suprarrenales por parte de la angiotensina II, lo cual libera aldosterona. La aldosterona es una hormona que actúa sobre el receptor de mineralocorticoides en los riñones. La activación de estos receptores conduce a un aumento en la retención de sodio y agua y a un aumento en la excreción de potasio.
Dado que la angiotensina II es el producto de una reacción catalizada por la ECA, la inhibición de la ECA disminuye la producción de angiotensina II. Menos angiotensina II significa menor vasoconstricción y menor retención de agua y sodio.
Por lo tanto, este es el mecanismo mediante el cual los inhibidores de la ECA y los bloqueadores del receptor de angiotensina 2 tipo 1 reducen la presión arterial.
Un error bastante común está en pensar que este sistema únicamente regula la tensión arterial, y nada más lejos de la realidad, ay que uno de los principales problemas que nos encontramos en los usuarios de anabolizantes es que el uso de estos conduce a una sobre-activación de este sistema como se ha mencionado anteriormente, lo cual conduce a una pérdida de funcionalidad cardíaca, hipertrofia del miocardio y daño renal [7], de hecho, es este sistema el que conduce a la aparición de los efectos secundarios más graves derivados del abuso de anabolizantes.
En cuanto a su efecto hipotensor, un metanálisis de Cochrane encontró que los inhibidores de la ECA redujeron la presión arterial sistólica en 8mmHg y presión arterial diastólica en 5mmHg en hipertensión la primaria [8], lo interesante es que una dosis igual al 50% de la dosis diaria máxima recomendada por el fabricante logró un efecto hipotensor del 90% de la dosis máxima, asimismo, no se encontró ninguna diferencia clínicamente significativa en la reducción de la presión arterial entre los distintos inhibidores de la ECA.
Así que, en general, los inhibidores de la ECA tienen un efecto muy modesto sobre la presión arterial por lo que, como norma general si el único objetivo es el de reducir la tensión arterial, hay opciones mucho mejores y más eficaces.
Ejemplos de inhibidores de la ECA son el benazepril, captopril, enalapril, lisinopril, perindopril, ramipril y en general, todos los acabados en “-pril”.
En cuanto a ejemplos de antagonista de los receptores de angiotensina II tenemos el losartán, valsartán, candesartán, telmisartán y todos los acabados en “-sartán”.
En cuanto a su seguridad, como norma general, estos fármacos son bastante seguros, pero pueden tener algunos efectos secundarios algo molestos como la tos seca, entre estos efectos secundarios se incluyen, pero no se limitan a síndrome de la primera dosis, tos, hiperpotasemia, erupciones cutáneas, alteración del gusto (disgeusia), hepatotoxicidad y angioedema (siendo este último el más grave de todos).
El síndrome de la primera dosis se refiere a la caída repentina de la presión arterial que puede ocurrir en las primeras etapas del tratamiento, esto podría hacer que te desmayes, pero puede ser manejado bastante bien tomando inicialmente una dosis baja, preferiblemente a la hora de acostarse, para que no te caigas y te des un golpe o similar; De hecho, tomar este tipo de medicamentos la hora de acostarse da como resultado un efecto terapéutico mayor y a una disminución de los principales eventos cardiovasculares en comparación con la ingesta por la mañana [9].
La hiperpotasemia puede darse debido al efecto ahorrador de potasio de este tipo de fármacos, sin embargo, es raro desarrollar hiperpotasemia sin el uso concomitante de otros medicamentos ahorradores de potasio a altas dosis (o ingesta muy alta de potasio) o insuficiencia renal ya existente.
La tos seca e irritante es un efecto secundario bastante común de los inhibidores de la ECA, con una ocurrencia de aproximadamente 1 de entre cada 10 personas, aunque la incidencia real podría ser aún mayor [10]. Si bien no es dañina, la tos puede empeorar lo suficiente como para que la persona desista de tomar el fármaco.
En cuanto a las erupciones cutáneas, un pequeño porcentaje de personas desarrollan una al iniciar la terapia con inhibidores de la ECA [11], reducir la dosis o cambiar de fármaco ayuda con este problema y, en particular el captopril, parece tener un mayor riesgo de inducir una erupción en comparación con otros inhibidores de la ECA.
Los iECA también parecen causar alteraciones del gusto, o disgeusia, en un pequeño número de los pacientes y esto es probablemente dependiente de la dosis. Algunas personas lo describen como un sabor metálico, otros como un sabor dulce, y otros como cosas con un sabor diferente al que solía tener, nada malo, pero sin duda puede llegar a ser muy molesto.
En raras ocasiones, los inhibidores de la ECA pueden producir hepatotoxicidad, causando colestasis, hepatitis colestásica o lesión hepatocelular [12], sin embargo, estos efectos secundarios parecen limitarse a reportes de casos (series) en la literatura.
Finalmente, un efecto secundario potencialmente letal de los inhibidores de la ECA es el angioedema. En el angioedema, se acumula líquido debajo de la piel o las membranas mucosas, esto puede darse en la cara, mucosa oral, lengua, labios, y también en la faringe y laringe [13].
En función de la localización, se pueden bloquear las vías respiratorias, lo que pone en peligro la vida del paciente. La incidencia de angioedema con iECA es del 0,3 % frente al 0,07 % con placebo [14], por lo que, en caso de producirse, debe interrumpirse su uso de manera inmediata.
Además, parece afectar principalmente a los ancianos, mujeres y con mayor frecuencia a los de origen africano, asimismo, con los ARAII, la incidencia es mucho menor (0,13%, lo cual no tiene diferencia significativa con respecto al placebo).
Restricción de sodio
El alto consumo de sodio en la dieta se ha asociado con un aumento de la presión arterial, proponiéndose una relación causal basada en la evidencia actualmente disponible [15].
En cambio, se ha visto que la restricción de sodio en la dieta disminuye la presión arterial; En un metanálisis Cochrane de 2013 se encontró que una reducción de 4,4g/día de la ingesta de sal en la dieta (es decir, 1,8g sodio) condujo a una reducción de 4,2mmHg en la presión arterial sistólica y una reducción de 2,1mmHg en la presión arterial diastólica [16].
El efecto fue más pronunciado en pacientes hipertensos, en este grupo, se produjo una reducción de 5,4mmHg en la presión arterial sistólica y una reducción de 2,8mmHg reducción de la presión arterial diastólica.
Por ende, ¿qué tanto deberíamos reducir nuestra ingesta de sodio? La evidencia actual sugiere que las personas hipertensas con una ingesta de sodio de 7g/día o más tienen un mayor riesgo de eventos cardiovasculares y muerte en comparación con aquellos con una ingesta de sodio de 4 a 5g/día [17].
La Sociedad Europea de Hipertensión recomienda que la ingesta de sodio se limite a 2g/día (es decir, 5g de sal por día) en la población general y que se trate de lograr este objetivo en todos los pacientes hipertensos [18].
Nutracéuticos
Los nitratos (NO3-) son un compuesto inorgánico formado por nitrógeno y oxígeno que se encuentra naturalmente en el suelo y en el agua y también es un importante componente de los fertilizantes agrícolas.
Esto último es debido a que las plantas emplean el nitrógeno de estos para producir aminoácidos, que son los componentes básicos de las proteínas, por lo tanto, la adición de nitrato al suelo de cultivo ayuda a que las plantas crezcan más rápidamente.
Sin embargo, uno de los grandes avances en los últimos años es el descubrimiento de que el NO (Óxido Nítrico, creado en nuestro cuerpo a partir de los nitratos y la arginina) es una molécula de señalización de vital importancia en el cuerpo humano para mantener una correcta salud cardiovascular.
Por ejemplo, una de sus principales funciones es la de facilitar la vasodilatación (ensanchamiento) de los vasos sanguíneos, promoviendo un aumento del flujo sanguíneo y regulando la presión arterial, y sabemos que el aporte dietético de nitratos proporciona una vía importante para la síntesis de este gas.
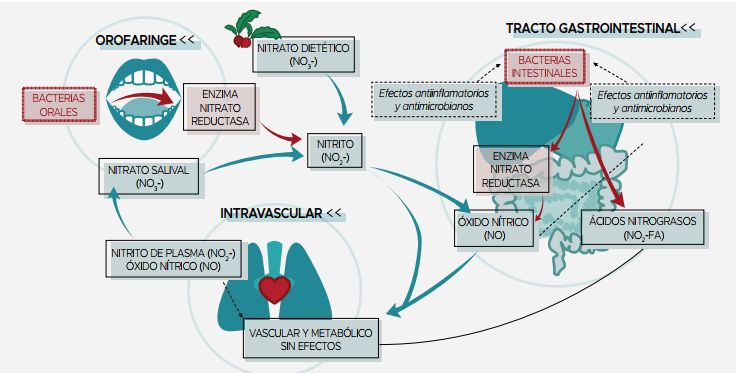
Imagen 6: Ingesta de nitratos y su conversión a nitritos y óxido nítrico en nuestro organismo. Es importante tener en cuenta que el uso de enjuagues bucales que contengan clorhexidina o algún otro agente antibacteriano reduce significativamente la reducción de nitratos en nitritos. Esto es debido a que algunas bacterias de la cavidad oral (las cepas Veillonella, Actinomyces, Rothia y Staphylococcus epidermidi) son las encargadas de la reducción de nitratos a nitritos mediante la acción de la enzima nitrato reductasa (la cual no existe en seres humanos).
Por ello, el uso de nitratos ha demostrado reducir de forma consistente la tensión arterial tanto en personas sanas [19] como hipertensas [20], efectos que van desde una reducción de 8mmHg en la presión arterial sistólica y una reducción de hasta 4mmHg en la presión arterial diastólica, en función de la dosis, población y duración de la intervención.
También tenemos las procianidinas, las cuales ayudan a mejorar diferentes índices de función cardiovascular, principalmente al ayudar a potenciar el metabolismo del óxido nítrico (NO), de los más interesantes son aquellas que encontramos por ejemplo en el extracto de semilla de uva; en 2016, un metanálisis encontró que el uso de extracto de semilla de uva condujo a una reducción de media en la presión arterial sistólica de hasta 6mmHg y de hasta 2,8mmHg en la presión arterial diastólica [21], pudiéndose llegar a duplicar dicha cifra en función del estado de salud de la persona y de la dosis empleada.
Referencias
- Williams B, Mancia G, Spiering W, Agabiti Rosei E, Azizi M, Burnier M, Clement DL, Coca A, de Simone G, Dominiczak A, Kahan T, Mahfoud F, Redon J, Ruilope L, Zanchetti A, Kerins M, Kjeldsen SE, Kreutz R, Laurent S, Lip GYH, McManus R, Narkiewicz K, Ruschitzka F, Schmieder RE, Shlyakhto E, Tsioufis C, Aboyans V, Desormais I; ESC Scientific Document Group. 2018 ESC/ESH Guidelines for the management of arterial hypertension. Eur Heart J. 2018 Sep 1;39(33):3021-3104. doi: 10.1093/eurheartj/ehy339. Erratum in: Eur Heart J. 2019 Feb 1;40(5):475. PMID: 30165516.
- Lewington S, Clarke R, Qizilbash N, Peto R, Collins R; Prospective Studies Collaboration. Age-specific relevance of usual blood pressure to vascular mortality: a meta-analysis of individual data for one million adults in 61 prospective studies. Lancet. 2002 Dec 14;360(9349):1903-13. doi: 10.1016/s0140-6736(02)11911-8. Erratum in: Lancet. 2003 Mar 22;361(9362):1060. PMID: 12493255.
- Ettehad D, Emdin CA, Kiran A, Anderson SG, Callender T, Emberson J, Chalmers J, Rodgers A, Rahimi K. Blood pressure lowering for prevention of cardiovascular disease and death: a systematic review and meta-analysis. Lancet. 2016 Mar 5;387(10022):957-967. doi: 10.1016/S0140-6736(15)01225-8. Epub 2015 Dec 24. PMID: 26724178.
- Brunström M, Carlberg B. Association of Blood Pressure Lowering With Mortality and Cardiovascular Disease Across Blood Pressure Levels: A Systematic Review and Meta-analysis. JAMA Intern Med. 2018 Jan 1;178(1):28-36. doi: 10.1001/jamainternmed.2017.6015. PMID: 29131895; PMCID: PMC5833509.
- Johannsson G, Gibney J, Wolthers T, Leung KC, Ho KK. Independent and combined effects of testosterone and growth hormone on extracellular water in hypopituitary men. J Clin Endocrinol Metab. 2005;90(7):3989-3994.
- Sattler FR, Castaneda-Sceppa C, Binder EF, et al. Testosterone and growth hormone improve body composition and muscle performance in older men. J Clin Endocrinol Metab. 2009;94(6):1991-2001.
- Kienitz T, Quinkler M. Testosterone and blood pressure regulation. Kidney Blood Press Res. 2008;31(2):71-9. doi: 10.1159/000119417. Epub 2008 Mar 4. PMID: 18319594.
- S. Heran, M. M. Wong, I. K. Heran, and J. M. Wright. Blood pressure lowering efficacy of angiotensin converting enzyme (ace) inhibitors for primary hypertension. Cochrane Database of Systematic Reviews, (4), 2008.
- C. Hermida, J. J. Crespo, M. Domínguez-Sardiña, A. Otero, A. Moyá, M. T. Ríos, E. Sineiro, M. C. Castiñeira, P. A. Callejas, L. Pousa, J. L. Salgado, C. Durán, J. J. Sánchez, J. R. Fernández, A. Mojón, D. E. Ayala, and H. P. Investigators. Bedtime hypertension treatment improves cardiovascular risk reduction: the Hygia Chronotherapy Trial. European Heart Journal, 10 2019. ehz754.
- Bangalore, S. Kumar, and F. H. Messerli. Angiotensin-converting enzyme inhibitor associated cough: deceptive information from the physicians’ desk reference. The American journal of medicine, 123(11):1016–1030, 2010.
- A. Weber. Safety issues during antihypertensive treatment with angiotensin converting enzyme inhibitors. The American journal of medicine, 84:16–23, 1988.
- Chitturi and J. George. Hepatotoxicity of commonly used drugs: nonsteroidal anti-inflammatory drugs, antihypertensives, antidiabetic agents, anticonvulsants, lipid-lowering agents, psychotropic drugs. In Seminars in liver disease, volume 22, pages 169–184.
- Campo, T. D. Fernandez, G. Canto, and C. Mayorga. Angioedema induced by angiotensin-converting enzyme inhibitors. Current opinion in allergy and clinical immunology, 13(4):337–344, 2013.
- Makani, F. H. Messerli, J. Romero, O. Wever-Pinzon, A. Korniyenko, R. S. Berrios, and S. Bangalore. Meta-analysis of randomized trials of angioedema as an adverse event of renin–angiotensin system inhibitors. The American journal of cardiology, 110(3):383–391, 2012.
- J. He and G. A. MacGregor. Salt, blood pressure and cardiovascular disease. Current opinion in cardiology, 22(4):298–305, 2007.
- J. He, J. Li, and G. A. MacGregor. Effect of longer-term modest salt reduction on blood pressure. Cochrane database of systematic reviews, (4), 2013.
- Mente, M. O’Donnell, S. Rangarajan, G. Dagenais, S. Lear, M. McQueen, R. Diaz, A. Avezum, P. Lopez-Jaramillo, F. Lanas, et al. Associations of urinary sodium excretion with cardiovascular events in individuals with and without hypertension: a pooled analysis of data from four studies. The Lancet, 388(10043):465–475, 2016.
- Williams, G. Mancia, W. Spiering, E. Agabiti Rosei, M. Azizi, M. Burnier, D. L. Clement, A. Coca, G. De Simone, A. Dominiczak, et al. 2018 esc/esh guidelines for the management of arterial hypertension. European heart journal, 39(33):3021–3104, 2018.
- Hobbs DA, George TW, Lovegrove JA. The effects of dietary nitrate on blood pressure and endothelial function: a review of human intervention studies. Nutr Res Rev. 2013 Dec;26(2):210-22.
- Bahadoran, Z., Mirmiran, P., Kabir, A., Azizi, F., & Ghasemi, A. (2017). The Nitrate-Independent Blood Pressure-Lowering Effect of Beetroot Juice: A Systematic Review and Meta-Analysis. Advances in nutrition (Bethesda, Md.), 8(6), 830–838.
- Zhang H, Liu S, Li L, Liu S, Liu S, Mi J, Tian G. The impact of grape seed extract treatment on blood pressure changes: A meta-analysis of 16 randomized controlled trials. Medicine (Baltimore). 2016 Aug;95(33):e4247. doi: 10.1097/MD.0000000000004247. PMID: 27537554; PMCID: PMC5370781.
